Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
3 Fe + 2 O2 → Fe3O4
2 Fe + 3 Cl2 → 2 FeCl3
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe2+ — 2e → Fe
Катод: 2H+ + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Защитные покрытия
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Самые легкие цветные металлы
Наиболее распространенный способ классификации цветных металлов по их физико-химическим свойствам — на семь групп, среди которых выделяют так называемые тяжелые и легкие цветные металлы. Это традиционное определение основано на плотности материала.
В основной список входят алюминий, магний, титан, литий, олово и бериллий. К этой же группе относятся кадмий, таллий, галлий, висмут, индий и другие элементы.
Производство легких сплавов является чрезвычайно энергоемким, поэтому предприятия, специализирующиеся в этой области металлургии, располагаются вблизи источников дешевой энергии.
Удивительное о других металлах
- Известный своей невероятной прочностью титан чаще всего используется не в машиностроительной или другой технической промышленности (всего 7%), а в изготовлении красок (60%), бумажной продукции (13%) и различных синтетических пластиков, на долю которых приходится 20%.
- Когда перед американцами встала необходимость изготовления дозиметров для спутника, предназначенного для измерения радиационного фона, ими было принято решение достать со дна и распилить судно, затонувшее еще во время мировой войны. Вся сталь, выпущенная после 1945 г., давала недопустимый для таких приборов радиационный фон, который исказил бы достоверность получаемых данных.
- Присутствие металлов в звездах и галактиках указывают на их возраст. Чем моложе звезда, тем больше она металлизирована.
- Если разлить в самолете ртуть, она проделает в фюзеляже дырку. Именно этим объясняется запрет на ее перевозку в воздушных судах.
- В бескислородной среде металлы не образуют оксидной пленки на поверхности и приклеиваются друг к другу.
- Основным элементом всех обменных реакций в организме человека является медь. В настоящее время на основе этого металла разработана смесь, способная активизировать жизненно важные обменные процессы при ее соприкосновении с эпидермисом.
- Всего 150 лет назад алюминий ценился дороже серебра и золота. Французские офицеры носили на мундирах алюминиевые пуговицы как символ высшего благородства. Сам Бонапарт и его наиболее почетные гости ели на званых обедах алюминиевыми вилками, в то время как более простое сословие пользовалось обычным столовым серебром.
- В средние века немецкие шахтеры долго и тщетно пытались получить медь из поднятой из шахт руды, которая имела большое внешнее сходство с медной. Поскольку ничего у них не получалось, они решили, что им препятствует злой дух, которому было дано имя Никель (озорник). Именно так и был назван метал, который удалось получить из этой руды лишь в XVIII веке.
Серебро имеет бактерицидные свойства
Серебро было известно людям еще до нашей эры. Какое-то время оно даже ценилось выше золота. Однако о его разных свойствах люди узнают до сих пор.
Например, о непосредственном влиянии ионного серебра на бактерии все еще ведутся споры. Доказано, что при соприкосновении бактерий и ионов, первые погибают в результате воздействия.
Было выдвинуто уже множество теорий, однако точно все еще неизвестны причины гибели микроорганизмов под воздействием серебра.
Ионы этого металла хорошо справляются с возбудителями тифа, протеи, дифтерии и других. Там, где серебро не уничтожает бактерии, оно может замедлить процесс прорастания новых спор и распространения микроорганизмов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
С неметаллами
4 Li + O2→ 2 LiO2
3 Mg + N2 → Mg3N2
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
С оксидами металлов
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
С кислотами
Mg + H2SO4(разб)→MgSO4 + H2
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
С растворами солей
Fe + CuSO4→ Cu + FeSO4
Cu + 2 AgNO3→ 2 Ag + Cu(NO3)2
Более активные металлы вытесняют из соединений менее активные.
Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Ca + 2 H2O →Ca(OH)2 + H2
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.
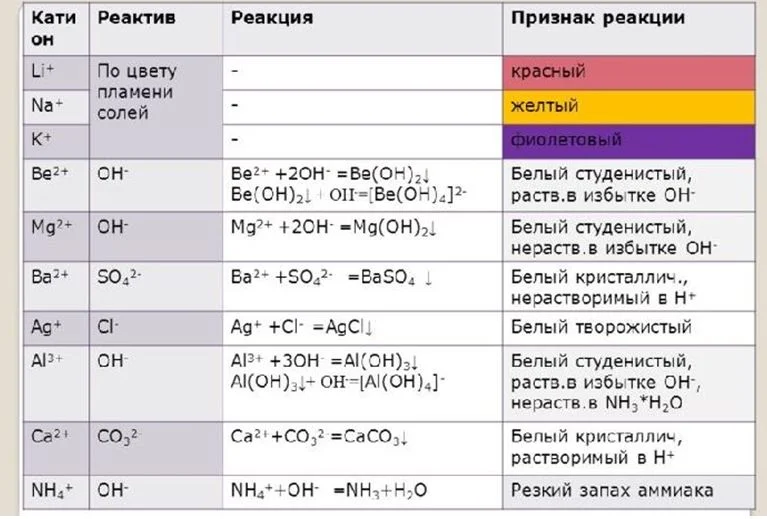
Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
3Li+ + PO43- = Li 3РО 4↓
В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
Li+ + F- = LiF↓
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Na+ + [Sb (OH)6]– = Na[Sb(OH)6] ↓
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6] ↓+ 2Na+
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
K+ + NaHC4H406= KHC4H4O6↓ + Na+.
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
9. Бериллий
 А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
А вот к этому металлическому красавцу лучше не приближаться без средств защиты. Потому что бериллий высокотоксичен, и обладает канцерогенным и аллергическим действием. Если вдыхать воздух, содержащий пыль или пары бериллия, то возникнет заболевание бериллиоз, поражающее легкие.
Однако бериллий несет не только вред, но и благо. Например, добавьте всего 0,5 % бериллия в сталь и получите пружины, которые будут упругими даже если довести их до температуры красного каления. Они выдерживают миллиарды циклов нагрузки.
Бериллий применяют в аэрокосмической промышленности для создания тепловых экранов и систем наведения, для создания огнеупорных материалов. И даже вакуумная труба Большого Адронного Коллайдера сделана из бериллия.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
-
/10
Вопрос 1 из 10
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.

Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
Литий добавляется во многие сплавы для улучшения металлических свойств.
Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
Франций пока не имеет практического применения в связи с высокой радиоактивностью.
Самый радиоактивный металл
Единственным металлом, который может использоваться в качестве топлива в ядерных реакторах, является уран. Многие люди считают его очень опасным из-за высокой радиоактивности. Однако природный уран безопасен для здоровья человека, а опасность представляет его разновидность под названием U-235 — именно она используется в ядерных реакторах.
Когда-то давно из природного урана даже изготавливали посуду. Например, осколки желтого стекла с содержанием урана были найдены на территории итальянского города Неаполь — по расчетам ученых, стекло было изготовлено в 79 году нашей эры. Он был безопасен для людей и никаких намеков на радиацию вроде свечения не наблюдалось.
Природного урана U-235, пригодного для использования в ядерных реакторах, сегодня в природе очень мало — на протяжении долгих лет он просто улетучился. Зато миллиарды лет назад его было очень много, и ядерные реакции могли запускаться прямо на природе, без участия человека. Так, на территории африканской страны Габон, около 1,8 миллиарда лет назад происходила естественная реакция деления ядер урана. Уран горел на протяжении сотен лет, но в итоге реакция прекратилась из-за истощения запасов металла.
Химические свойства[править | править код]
Металлический цезий является наиболее химически активным металлом, и одним из наиболее реакционноспособных химических элементов. Взаимодействие цезия с воздухом сопровождается сильным взрывом, и в значительной степени это обусловлено присутствием паров воды, которая весьма резко ускоряет реакцию, с водой, водным льдом (даже при охлаждении до -120 °C(!)), простыми спиртами, галогеноорганическими соединениями (фреоны и др), галогенидами тяжёлых металлов, кислотами, «сухим льдом» (взаимодействие протекает с сильнейшим взрывом и вспышкой красного цвета). Исключительно высокая химическая активность металлического цезия обусловлена не только высоким отрицательным электрохимическим потенциалом, но и невысокой температурой плавления и кипения (быстро развивается очень большая контактная поверхность, испарение). Все виды солей, образуемых цезием — нитрат, хлорид, бромид, фторид, йодид, хромат, перманганат, перхлорат, хлорат, азид, цианид, карбонат и т
д — чрезвычайно легко растворимы в воде и в целом ряду органических растворителей, из которых наименее растворим перхлорат (что важно для технологии получения и очистки цезия). Следует отметить то обстоятельство что хотя цезий и весьма активный металл, тем не менее он при обычных условиях не вступает в реакцию с азотом в отличии от лития, и даже при сильнейшем нагревании не способен образовать с азотом соединений в отличие от бария, кальция, магния и ряда других металлов
Нитрид и азид цезия могут быть получены только косвенными методами. Гидроксид цезия — сильнейшее основание с высочайшей электропроводностью в водных растворах; так, например, при работе с ним необходимо учитывать, что концентрированный раствор CsOH разрушает стекло даже при обычной температуре, а расплав разрушает железо, кобальт, никель, а также платину, корунд и диоксид циркония, и даже постепенно разрушает серебро и золото (а в присутствии кислорода — очень быстро). Единственным устойчивым в расплаве гидроксида цезия металлом является родий (и его некоторые сплавы).
Самый дорогой в мире металл
Этот химический элемент, калифорний-252, не добывают из недр земли, а получают искусственным путем. И не в обычных лабораториях, а в реакторах, как результат целенаправленной ядерной реакции, представляющей собой целую линейку распадов. Его количество измеряется не килограммами и даже не граммами, а атомами. Весь мировой запас калифорния за все время его производства специалисты оценивают в количество, не превышающее 5 граммов. Отсюда и его стоимость на мировом рынке — в разное время она колебалась от 6,5 до 27 миллионов долларов за 1 грамм.
Несмотря на впечатляющую стоимость, калифорний востребован во многих отраслях благодаря своим невероятным свойствам. С помощью миниатюрного его количества можно обнаруживать глубинные залежи золота, серебра и нефти, изучать дальние звезды и планеты, проверять целостность авиационно-космических аппаратов и ядерных реакторов, обнаруживать особо хитро спрятанные наркотики даже там, где они недоступны для рентгеновских лучей.
Особой областью применения калифорния-252 является онкология. Мельчайшая крупица этого металла, введенная на кончике иглы, мгновенно уничтожает своим излучением патологически измененные ткани организма. При этом скорость пробега нейронов настолько мала, что здоровые участки не подвергаются излучению. Сегодня это исключительно редкий металл, но у него огромные перспективы в будущем.
История открытия металлов
Оба элемента были открыты на заре XIX века ученым Смитсоном Теннантом. Многие исследователи того времени занимались изучением свойств сырой платины, обрабатывая ее «царской водкой». Только Теннанту удалось обнаружить в полученном осадке два химических вещества:
- осадочный элемент со стойким запахом хлора ученый назвал осмием;
- субстанция с меняющейся окраской получила название иридий (радуга).
Оба элемента были представлены единым сплавом, который ученому удалось разделить. Дальнейшим исследованием самородков платины занялся русский химик К. Клаус, тщательно исследовавший свойства осадочных элементов. Сложность определения самого тяжелого металла в мире заключается в невысокой разности их плотности, которая не является величиной постоянной.
Интересные факты
- Титановые сплавы, удельный вес которых превышает удельный вес алюминия примерно на 70%, в 4 раза прочнее алюминия. Поэтому с точки зрения удельной прочности сплавы, содержащие титан, более жизнеспособны для использования в самолетостроении.
- Многие алюминиевые сплавы превышают удельную прочность сталей, содержащих углерод. Алюминиевые сплавы очень пластичны, устойчивы к коррозии и прекрасно поддаются обработке давлением и резанием.
- Пластмассы имеют более высокую удельную прочность, чем металлы. Однако из-за недостаточной жесткости, механической прочности, старения, повышенной хрупкости и низкой теплостойкости ламинаты, текстолит и сэндвич-пластики имеют ограниченное применение, особенно в крупногабаритных конструкциях.
- Было установлено, что черные и цветные металлы и многие их сплавы уступают стеклопластикам по коррозионной стойкости и удельной прочности.
 Механические свойства металлов являются важным фактором, влияющим на их применение на практике. При проектировании любой конструкции, детали или машины и выборе материала необходимо учитывать все механические свойства, которыми он обладает.
Механические свойства металлов являются важным фактором, влияющим на их применение на практике. При проектировании любой конструкции, детали или машины и выборе материала необходимо учитывать все механические свойства, которыми он обладает.
Какие металлы встречаются чаще всего?
Металлы, встречаемые чаще всего, называют распространенными. Доля их в земной коре превышает одну десятую процента. Роль таких металлов в развитии цивилизации велика. Недаром мы знаем о «Железном веке», слышали о «Космическом металле», знаем что такое «Крылатый металл». Все эти выражения касаются таких металлов, как марганец, алюминий, титан, железо и магний.
Марганец относится к металлам, которые часто встречаются в природе
Данные распространенные металлы — составляющие многих минералов. Известно, что в России железо, хром и марганец находятся по объему производства на второй позиции после топливно-энергетических ресурсов. Известно, что ресурс железа в мире практически неограничен, но многие страны импортируют железные руды, это относится и к России.
Железо очень распространенный металл
Широко распространен в земле алюминий. В мире его производство достигает двадцати миллионов тонн, при этом используются в основном бокситы. Известно, что по запасам бокситов Россия занимает девятую позицию, хотя она на втором месте по производству первичного металла.
Нахождение в природе и получение[править | править код]
Руды и минералыправить | править код
Основной рудой цезия является поллуцит, а вспомогательными рудами имеющими меньшее значение но используемые промышленностью высокоразвитых стран для добычи цезия а так же рубидия являются: Авогадрит, Лепидолит, Биотит, Амазонит, Петалит, Берилл, Циннвальдит, Лейцит и другие. Все они являются алюмосиликатами (кроме авогадрита — это борофторид калия).
Мировые ресурсыправить | править код
Цезий входит в группу элементов с ограниченными запасами вместе с гафнием, танталом, бериллием, рением, платиноидами, кадмием, теллуром. Общие выявленные мировые ресурсы руд составляют около 180 тыс. тонн (в пересчёте на окись цезия), но они крайне распылены, и, к сожалению, сверхвысокие цены — это неотъемлемая черта, сопровождающая цезий и рубидий в прошлом, настоящем и будущем. Мировой объём добычи цезия составляет около 9 тонн в год, а потребности свыше 85 тонн в год и она постоянно растёт. По добыче цезиевой руды (поллуцита) лидирует Канада. В месторождении Берник-Лейк (юго-восточная Манитоба) сосредоточено около 70% мировых запасов цезия. Поллуцит также добывается в Намибии и Зимбабве. В России его мощные месторождения находятся на Кольском полуострове, в Восточном Саяне и Забайкалье
Месторождения поллуцита также имеются в Казахстане, Монголии и Италии (о.Эльба), но обладают малыми запасами и не имеют важного экономического значения. У цезия есть и недостатки, которые обусловливают постоянный поиск его минералов, это то обстоятельство что во первых его извлечение из руд неполное, в процессе эксплуатации материала он рассеивается и потому безвозвратно теряется, запасы его руд очень ограничены и не могут обеспечить постоянно растущий спрос на металлический цезий (потребности в металле более чем в 8,5 раз превышают его добычу и положение в металлургии цезия ещё более тревожное чем например в металлургии тантала или рения)
Сюда же можно указать что промышленность нуждается именно в очень чистом материале (на уровне 99,9—99,999 %) и это является одной из труднейших задач в металлургии редких элементов. Для получения цезия достаточной степени чистоты требуется многократная ректификация в вакууме, очистка от механических примесей на металлокерамических фильтрах, нагревание с геттерами для удаления следов водорода, азота, кислорода, с помощью очень чистого циркония (геттер), и многократная ступенчатая кристаллизация. Цезий весьма активен и агрессивен по отношению к контейнерным материалам и требует хранения например в сосудах из специального стекла в атмосфере аргона или водорода (обычные марки лабораторного стекла цезий разрушает).
Производство чистого элементаправить | править код
Так как промышленности требуется только цезий особой чистоты то основным способом получения такого материала является длительное разложение небольших количеств азида цезия в вакууме (способ опасен ввиду возможности взрывов азида цезия).
Обычно выделяют два основных способа извлечения цезия в виде соединений из поллуцита.
1) Хлоридное вскрытие — минерал обрабатывается подогретой соляной кислотой, а потом при добавлении SbCl3 осаждают Cs3, который затем обрабатывают горячей водой или раствором аммиака.
2) Сульфатное вскрытие — минерал обрабатывается подогретой серной кислотой, в результате чего получают алюмо-цезиевые квасцы CsAl(SO4)2 * 12H2O.
3) Прямое восстановление поллуцита — метод прямого восстановления поллуцита находится на стадии экспериментальных исследований и маломасштабного производства цезия. Сущность метода заключается в нагревании смеси порошкообразного поллуцита, окиси кальция и небольшого избытка восстановителя (алюминий, кремний, или их сплавы) при температуре 1050-1150 С и низком давлении 102-1,02 Па. По другой схеме, поллуцит вначале нагревают до 900 С для удаления влаги, а затем нагревают до 900-950 С в смеси с металлическим кальцием. При это практически достигается извлечение до 85 % цезия содержащегося в поллуците, а расход кальция доходит до 3-х весовых частей на одну весовую часть поллуцита содержащего до 35% Cs2O. При использовании в качестве восстановителя металлического натрия при 700-800 С в инертной атмосфере (азот, аргон) выход цезия в среднем достигает 75-95 %, но полученный металлический цезий содержит до 10 % натрия, и нуждается в дополнительных методах очистки.












